干细胞治疗:让肾脏损伤也得到干细胞的“照耀”
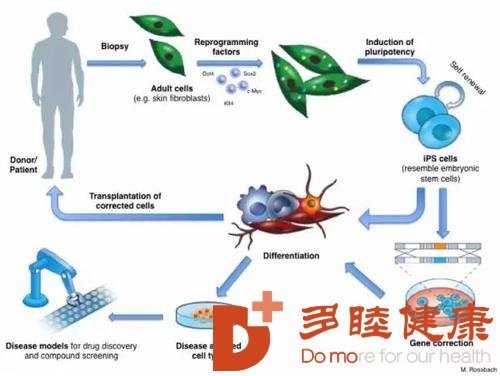
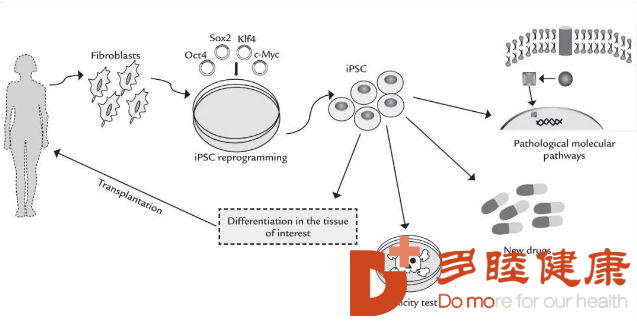
[本文为疾病百科知识,仅供阅读] 发布日期:2020-01-09 阅读:1,805在过去的几年里,人们对利用诱导多能干细胞(iPSC) 再生人类肾组织的想法产生了极大的兴趣。目前这一领域的进展主要依赖于动物模型,特别是对于小鼠的研究,研究人员希望能明确生成肾脏的细胞类型以及相互作用。细胞工程学技术的进步,也给研究带来了新的可能。对于正在发育中的人类肾脏,现在可以通过单细胞转录组学实现精准表达;与此同时,iPSC 可通过定向分化来提供细胞。对这些等效细胞的研究,贯穿了整个发育过程。
来自澳大利亚墨尔本大学儿科系 & 解剖与神经科学系 Melissa H. Little 教授对 2019 年肾脏病领域的干细胞研究进行了总结。
2019 年一个重要的发现就是见证了诱导多能干细胞(iPSC)衍生肾单位祖细胞的产生,对于在类肾器官中肾单位形成有了更多理解。而对斑马鱼再生的基础研究则为我们如何利用 iPSC 衍生细胞在体内再生人肾单位提供了非常重要的信息。
肾单位祖细胞
肾脏形成的关键细胞是肾单位祖细胞,它存在于发育中肾脏外周一些「凹」进去的地方(龛)。这些间充质细胞群不断刺激输尿管上皮,形成分支,同时自我更新,提供了形成肾单位的细胞。
肾单位祖细胞在胎儿发育过程中持续存在,最终在小鼠肾脏中形成大约 14000 个肾单位(在人类,这个数值大约是 100 万)。在小鼠出生后不久,肾单位祖细胞就消失了;而人类在出生之前肾单位祖细胞就已经消失。因此,出生之后的肾脏无法形成新的肾单位。
也正因为这种特性,肾单位祖细胞一直是生长发育和再生领域的研究热点。科学家一直在努力在体外重建肾单位祖细胞,一旦成功的话,那将是再生医学的突破性进展。2019 年,这些领域都有了一些新的进展。
10 多年前,在小鼠模型中的研究表明,肾单位的上皮细胞是由表达 SIX2 帽的间充质细胞转化而来的。2019 年的研究也首次发现,在人 iPSC 来源的类肾中,其肾单位也源于表达 SIX2 的细胞。
在进一步对类肾模型中肾脏发生的时机进行研究时,通过基因工程对 SIX2 进行标记,发现肾单位的形成是在短时间内发生的。在类肾器官形成的晚期,仍可见到 SIX2 阳性的细胞,但此时这些细胞不再有助于肾单位的形成,这可能是由于缺乏适合干细胞的微环境(即之前说的「龛」)。
新的技术帮助更好理解机制
要营造这么一个「龛」是非常复杂的工程,很多团队都在研究体外造「龛」。在前期大量研究工作的基础上,Tanigawa 团队在 2019 报道了一种在体外维持和扩增人 iPSC 衍生肾单位祖细胞的有效方法。在这项研究中,研究人员重新评估了转化生长因子β(TGFβ)超家族的作用,证明了是激活素 A 而不是先前认为的 BMP7 可以在体外有效维持肾单位祖细胞。
同时在研究中,为了剔除非肾源性 SIX2 细胞群,建立了一种更加严格的筛选方法:荧光激活细胞分类法。这种方法亦可推广至其他 iPSC 系。
组装机制的突破
尽管我们从 iPSC 产生人肾单位的能力有所提高,但是如何把这个肾单位「组装」到位,几乎难倒了所有人。即使在正常的发育过程中,肾单位与输尿管上皮连接的机制仍不清楚。2019 年,在对斑马鱼的研究中,这一方面有了重大发现。
在斑马鱼中,一旦出现体重增加或者因各种损伤造成肾单位丢失,那么就会出现表达 lhx1a 的细胞聚集并融合到邻近的前肾小管远端。虽然这一融合现象已经很早就被发现,但是具体机制一直不清楚。最近的研究发现,这种聚集和侵入融合需要一种 Wnt 跨膜信号,同时远端肾单位产生 Fgf4 和 Fgf10,可以「吸引」聚集的细胞群到合适的位置开始「入侵 / 融合」。
一旦损伤造成肾单位丢失,那么这些 Fgf 配体就会上调,从而被聚集物上的 Fgfr1 受体感知,刺激斑马鱼的新肾发生。
2019 肾脏干细胞研究进展简介
通过对类肾器官的谱系追踪,证实了 SIX2 阳性的肾单位祖细胞参与了肾单位形成,且这个形成在时间上是有限的。
优化培养条件为体外维持 / 扩增人肾单位祖细胞提供了一种有效的、广泛适用的方法。
对斑马鱼的研究提高了我们对新形成的肾单位与邻近上皮细胞融合的理解
2019 年,日本ips细胞的这些新的发现,推动了干细胞研究进一步深入。我们可以想象一下,有一天,我们可以直接给肾衰竭的人群注射人肾单位祖细胞,来促进新的肾脏生成,这是多么诱人的画面。
本文链接地址:http://www.domo-kenkou.com/gxbzs/ndz/4165.html










