未来医学,会拥有一个潜在的创伤治疗手段
[本文为疾病百科知识,仅供阅读] 发布日期:2019-11-12 阅读:1,665什么是干细胞?干细胞在急诊创伤改善中到底扮演一个什么样的角色?
干细胞是一种多功能细胞,能够再生人体的各种组织,因此在创伤改善中有一定的临床潜力,特别是在骨折愈合、软骨愈合及创伤后炎症等方面。
干细胞的生物学
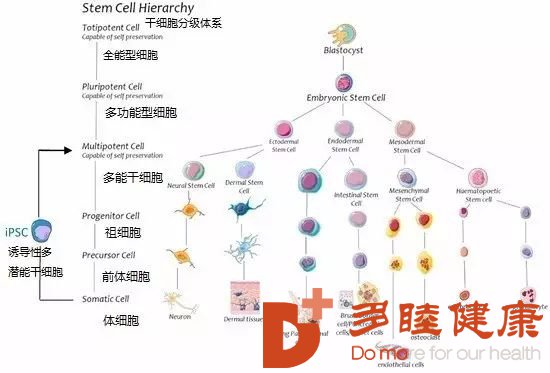
身体里的再生细胞可以根据能力来进行分类,其中再生能力最强是全能型的胚泡细胞,然后是多功能干细胞、祖细胞和前体细胞(如下图所示),这些细胞具有内在的再生能力,当然这里面也有与创伤相关的特殊干细胞。干细胞是未分化的细胞,从三个原始生殖层(内胚层、中胚层和外胚层)发展而来,具有自我更新和分化为各类成熟细胞的能力。这里主要介绍与创伤修复相关性的4种细胞:间质干细胞(MSC),造血干细胞(HSC),脂肪干细胞(ADSC)和内皮祖细胞(EPC)。其中MSC和HSC大部分主要存在于骨髓内,EPC位于内皮细胞,而ADSC存储于脂肪组织。值得注意的是,目前有新技术可以将收获的体细胞转化为诱导多能干细胞(iPSC)并获得潜在的再生能力。
间质干细胞(MSC)是一种多功能的干细胞,可以在中胚层内分化成任何非造血细胞,如成骨细胞、软骨细胞、脂肪细胞和骨髓细胞。它们的特征是细胞表面携带标志物CD105、CD73和CD90。MSC可以在多个部位采集,包括肌肉、脂肪组织、骨髓和自体脐带中,现有技术可以在体外进行筛选、培养和增殖以供在机体移植时使用。MSC是临床试验中研究最多的一类干细胞,骨髓间质干细胞由于缺乏MHC II类分子和协同刺激分子使得它们免疫原性削弱,与多功能胚胎干细胞相比它们也不会导致畸胎瘤的形成,这些性质使得它们在自体和异体的临床应用中更有吸引力。
造血干细胞(HSC)能够分化成为粒细胞或淋巴细胞,这些细胞的特征是表面携带标志物CD34、CD45、CD133和Thy1,它们能从骨髓及外周血中获得,可在恶性肿瘤如白血病细胞、淋巴瘤和骨髓衰竭等同种异体移植中应用。
脂肪干细胞(ADSC)由脂肪组织中获得,与骨髓来源的间质干细胞功能相似,这些细胞的特征是表面携带标志物CD90、CD73和CD44。
内皮祖细胞(EPC)具有血管生成的潜力,它们存在于外周循环中,表面携带标志物CD34,Flk-1和Tie-2。
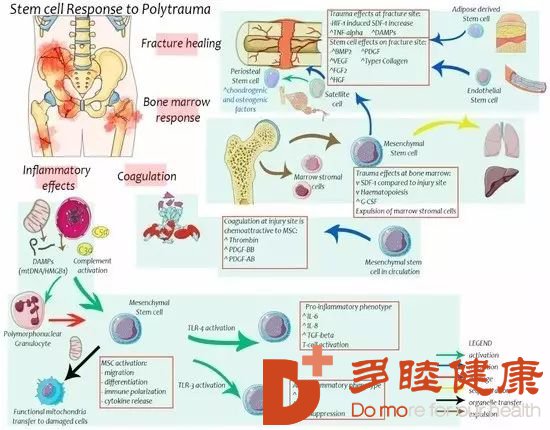
创伤对干细胞的影响
创伤导致组织结构性破坏,使组织灌注受损,并诱发炎症反应。干细胞对创伤的生理反应包括从它们的休眠状态中苏醒,从它们的原始居住场所中动员并向受伤的部位迁移,最后分化产生改善所需的特定细胞。此外,病理性的炎性反应不仅会导致干细胞的功能失调,同时会使干细胞的数量减少,最终将导致组织再生失败或其他不良预后。
干细胞在创伤愈合中的作用
骨折会引起骨髓内MSC的增生,骨折后会引起在骨髓和骨膜内的常驻干细胞迁移至损伤部位。在骨折部位需要有一定数量的干细胞进行修复,同时骨萎缩也被证实与骨折部位缺乏MSC有关。
充足的血供是干细胞迁移并存活的必要条件。Atesok, K等发现在小鼠骨折后进行纯化的EPC注射,有利于血管增生及更快的骨折愈合:在骨折部位EPC的血管生成效应与增加的亲血管生成因子hVEGF、hFGF2和hHGF 44的局部水平相关;同时还发现MSC的迁移与增加的小鼠骨痂体积和强度有关联。MSC约在EPC使用后第14天出现在骨折部位。这些改善效果与MSC迁移后局部BMP-21(骨形态生成蛋白)的表达有关。
干细胞已被证明能对机械刺激产生反应。体外研究已经证实了干细胞对以下刺激有反应,如牵拉、压迫、剪切、震荡、超声波等。在拉伸、压迫和超声波等刺激下,干细胞可表现出成骨分化。相反地,Dai等人发现,对小鼠的MSC进行反重力作用的试验可抑制其成骨分化。有研究表明在体外试验时,低强度脉冲超声波可促进MSC的成骨转化。
干细胞在软骨愈合中的作用
干细胞的功能与关节软骨损伤的恢复以及创伤后骨关节炎有关。在损伤的发生后,关节软骨中的MSC会分化成纤维细胞,而不是软骨细胞。创伤时关节组织纤维化的情况更少,由此表明创伤可引起干细胞分化的变化,并与创伤后骨性关节炎息息相关。
通过干细胞在关节内注射能改善创伤引起的软骨缺损。半月板组织再生增加,伴有骨关节炎患者的疼痛评分得到改善,且没有出现严重的不良反应。
使用MSC的改善方法有望能够改善骨关节炎和创伤后的软骨缺损。目前研究的重点是确定最佳的MSC来源、如何在植入前进行体外改造及更安全地使用。关于骨关节炎改善的已有多篇文献得出肯定的结论,只不过在临床应用前仍需要进行更多的研究。
干细胞在血管生成中的作用
对于创伤修复来说,恢复良好的血供是改善的关键。创伤可导致急性和迟发性的毛细血管损伤,包括直接伤害、血管闭塞或因外科手术改善创伤时所造成的医源性损伤。在受伤后,干细胞对血管生成有直接和间接的影响。一些研究表明,EPC迁移到受伤的部位后直接参与了新生血管的形成。其他的研究也已经证实EPC通过生长因子、细胞因子的调节促进新生血管生成。MSC和ADSC也有促进血管生成的类似作用。这些干细胞的血管生成功能最终有助于改善骨折的愈合、毛细血管再生、伤口的康复及减少炎症并发症。
干细胞在外伤后炎症反应中的应用
干细胞具有免疫调节功能,MSC可以转化为促炎症和抗炎细胞,它主要依赖于在创伤后炎症反应中分泌的介质如Toll样受体(TLR)。TLR是一种表面受体,它能结合病原体分子和损伤相关模式分子 (一类由创伤后细胞破坏释放的内源性产物,包括线粒体DNA(mtDNA),高机动性的编组框-1蛋白质和S100蛋白质等,具有激活免疫细胞的能力),在调控炎症反应中起着重要的作用。
创伤后引起的中性粒细胞和巨噬细胞激活会对干细胞造成损伤。在机体受伤后,中性粒细胞和干细胞一起迁移到受伤的部位,但它们迁移到创伤部位的时间点不同。中性粒细胞被激活后会释放活性氧,无意中损害了周围的细胞包括干细胞。如果损伤足够严重,中性粒细胞的激活状态持续存在(尤其是在细胞凋亡之后),那么干细胞就可能会被破坏。
严重的创伤后会导致骨髓衰竭,创伤后高炎症反应状态和G-CSF(粒细胞集落刺激因子)浓度升高将导致骨髓干细胞造血功能受损,并容易引发感染。在动物实验中发现通过MSC改善能逆转骨髓损伤。
推荐阅读:HER2+乳腺癌临床新标准!西雅图遗传学Tukysa获加入美国Oribis项目的全部监管机构
本文链接地址:http://www.domo-kenkou.com/jkzs/2318.html